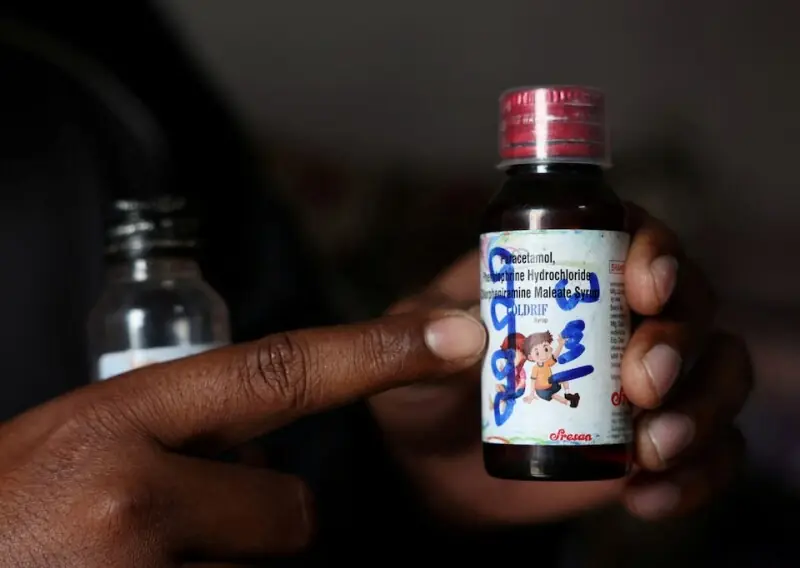
Oficiais indianos estão investigando se falhas de segurança no fornecimento de um ingrediente farmacêutico foram responsáveis pela contaminação de um xarope para tosse que matou pelo menos 24 crianças nos últimos meses, de acordo com três pessoas familiarizadas com o assunto. Os três oficiais de saúde e segurança de medicamentos do estado de Tamil Nadu disseram à Reuters que acreditam que o solvente usado para fazer um lote do xarope para tosse Coldrif pode ter sido contaminado com uma substância química tóxica por volta da época em que foi fornecido à fabricante de medicamentos, Sresan Pharmaceutical Manufacturer. A Sresan adquiriu 50 kg do solvente propilenoglicol (PG) da distribuidora local de produtos químicos Sunrise Biotech em 25 de março, que o havia comprado no mesmo dia da Jinkushal Aroma, uma pequena empresa que fabrica misturas de fragrâncias para detergentes líquidos e outros produtos químicos, de acordo com entrevistas com os fornecedores e um relatório de investigação de 3 de outubro pelo regulador farmacêutico de Tamil Nadu, visto exclusivamente pela Reuters. O Departamento de Controle de Drogas de Tamil Nadu não respondeu a repetidos pedidos de comentários sobre sua investigação. As autoridades disseram que o xarope Coldrif estava fortemente contaminado com uma toxina industrial conhecida, dietilenoglicol (DEG). As autoridades estão investigando como a substância química foi adicionada ao solvente, que é usado em xaropes para
tosse como base para dissolver seus ingredientes ativos. As mortes, que começaram em setembro, reavivaram preocupações sobre os padrões de segurança no setor farmacêutico indiano de US$ 50 bilhões, que foi manchado pelas mortes de mais de 140 crianças na África e na Ásia Central em 2022 e 2023 por xaropes para tosse fabricados na Índia com solventes contaminados. Após essas mortes, Nova Délhi prometeu melhorar os controles de qualidade. Funcionários da saúde indianos dizem que o DEG é às vezes usado de forma fraudulenta ou não intencional em medicamentos no lugar do PG mais caro. A ingestão de altos níveis tem sido associada a danos renais agudos e morte em crianças. A Reuters está relatando detalhes pela primeira vez sobre o foco da investigação indiana, bem como as violações nas práticas globais de segurança farmacêutica na entrega dos produtos químicos à Sresan. A licença de fabricação da Sresan foi revogada e seu fundador G. Ranganathan está sob custódia. Esforços para entrar em contato com representantes no escritório corporativo da Sresan e na casa de Ranganathan não tiveram sucesso. A Reuters não conseguiu identificar um representante legal para Ranganathan. A Central Drugs Standard Control Organisation, que supervisiona os produtos farmacêuticos federalmente, encaminhou as perguntas ao Ministério da Saúde da Índia, que por sua vez encaminhou a Reuters a uma declaração do governo dizendo que estava conduzindo mais inspeções de instalações farmacêuticas e revisando o uso pediátrico de xaropes para tosse. Os fabricantes de produtos químicos normalmente entregam solventes PG aos clientes em recipientes lacrados para evitar contaminação, mas a Sunrise confirmou à Reuters que havia reembalado o solvente sem um selo antes de entregá-lo. A Lei de Drogas e Cosméticos da Índia proíbe a venda e o manuseio de ingredientes de grau farmacêutico como PG medicinal por entidades que não possuem licenças de medicamentos. Nem a Jinkushal nem a Sunrise possuem licenças para manusear ingredientes de grau farmacêutico, confirmaram as duas distribuidoras por atacado à Reuters. Seus proprietários disseram que não sabiam que o PG que haviam vendido seria usado para fazer medicamentos. Tanto o operador da Sunrise, Vipul Jain, quanto o proprietário da Jinkushal, Jitender Vishwakarma, disseram que não manuseavam DEG altamente tóxico e não tinham conhecimento sobre como o solvente poderia ter sido contaminado. A Reuters não conseguiu estabelecer como a contaminação ocorreu ou quem foi o responsável. Inspeções conduzidas pelo regulador estadual após as mortes encontraram centenas de violações “críticas” e “graves” na fábrica da Sresan fora da cidade de Chennai, no sul, incluindo o armazenamento de produtos em “condições não higiênicas” e “falsificação de dados”, de acordo com o relatório de 3 de outubro. O regulador, no entanto, não relacionou essas violações diretamente às mortes. Produtos químicos reembalados O PG que a Sresan disse aos inspetores que usou foi produzido pelo fabricante sul-coreano SK picglobal, de acordo com um certificado de análise compartilhado pela Jinkushal e Sunrise com os investigadores, revisado pela Reuters. O certificado incluiu a data de fabricação do PG, bem como detalhes sobre seus conteúdos químicos. A Reuters não pôde verificar de forma independente a precisão dos conteúdos, embora um porta-voz da SK picglobal tenha dito que a cópia vista pela agência de notícias parecia autêntica. A SK picglobal exportou o solvente em um tambor lacrado de 215 kg para um distribuidor indiano, que o vendeu para a Jinkushal. Vishwakarma, da Jinkushal, disse que quebrou os selos e reembalou o solvente em sua loja antes de vender parte dele para a distribuidora de produtos químicos Sunrise. Jain, da Sunrise, disse que então transportou o produto químico para a Sresan em dois contêineres sem selos invioláveis porque a fabricante de medicamentos não queria toda a remessa original de 215 kg. O porta-voz da SK picglobal disse que a empresa proíbe estritamente a reembalagem ou redistribuição de seus produtos. Questionada se tais restrições estavam incluídas em seus contratos de venda, a empresa disse que disse aos clientes em reuniões que não “garante a qualidade dos produtos que foram reembalados ou arbitrariamente subdivididos para venda”. Não forneceu mais detalhes. Histórico de violações A Sresan já havia sido penalizada pelas autoridades, com seu fundador preso por um dia em 2020 e 2022 devido a preocupações sobre seus produtos, antes de receber uma multa, de acordo com quatro autoridades familiarizadas com o assunto. Eles não forneceram evidências documentais das penalidades. O ministro da saúde de Tamil Nadu disse aos legisladores no mês passado que a Sresan havia sido penalizada em 2021 e 2023 por “violações menores”, sem fornecer detalhes. Apesar do histórico da Sresan e dos regulamentos que exigem verificações anuais, a fábrica da fabricante de medicamentos não havia sido inspecionada desde 2023, disseram dois funcionários estaduais da saúde. A Reuters não pôde confirmar de forma independente quando a Sresan foi inspecionada pela última vez antes das mortes.
📝 Sobre este conteúdo
Esta matéria foi adaptada e reescrita pela equipe editorial do TudoAquiUSA
com base em reportagem publicada em
Brecorder
. O texto foi modificado para melhor atender nosso público, mantendo a precisão
factual.
Veja o artigo original aqui.









0 Comentários
Entre para comentar
Use sua conta Google para participar da discussão.
Política de Privacidade
Carregando comentários...
Escolha seus interesses
Receba notificações personalizadas